Sistēmas lietotājiem
Viltoto Zāļu Direktīva un Deleģētā Regula nosaka kārtību, kā drošuma pazīmes verificē un unikālo identifikatoru dzēš vairumtirgotāji un personas, kam atļauts vai kas tiesīgas iedzīvotājiem piegādāt zāles. Saskaņā ar Regulu un pašlaik spēkā esošajiem normatīvajiem aktiem Latvijā pie personām, kam atļauts vai kas tiesīgas iedzīvotājiem piegādāt zāles Latvijā, pieder aptiekas, slimnīcas, klīnikas, poliklīnikas, veselības centri, zobārstniecības klīnikas un prakses.
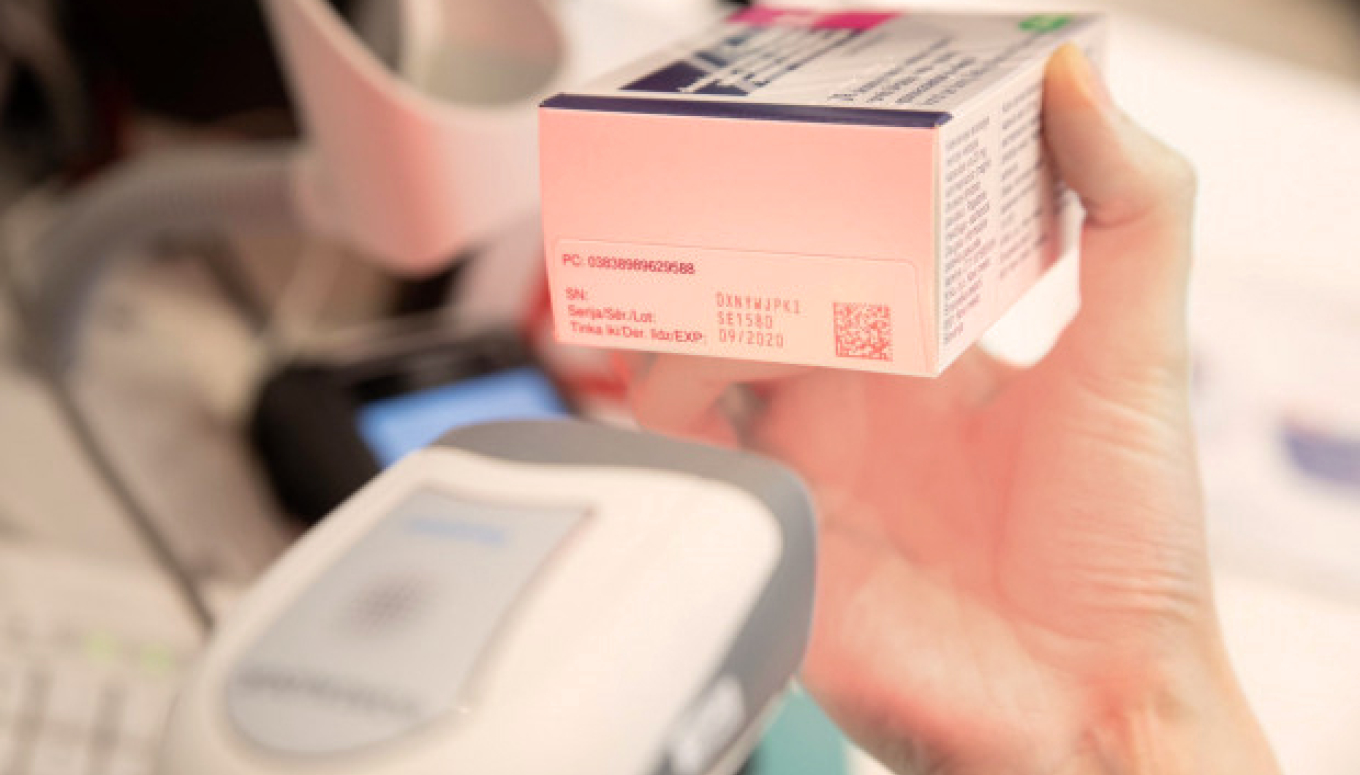
Latvijas zāļu verifikācijas sistēmā ietilpst lietotņu programmēšanas saskarnes, ar kuru starpniecību vairumtirgotāji, aptiekas, slimnīcas, klīnikas, poliklīnikas un veselības centri un ārstu prakses var šo sistēmu izvaicāt, izmantojot savu IT programmatūru, lai repozitoriju sistēmā verificētu unikālo identifikatoru autentiskumu un tos dzēstu.
Aptieku un citu personu, kam atļauts un kas tiesīgas iedzīvotājiem piegādāt zāles Latvijā, pienākums ir veidot IT savienojumu un pieslēgties nacionālajai repozitoriju sistēmai, kā arī veikt zāļu iepakojumu unikālā identifikatora verificēšanu un dzēšanu ar atbilstošu tehnisko nodrošinājumu (skeneri).
Aptiekām ir pienākums verificēt zāļu iepakojumus aprīkotus ar visām drošuma pazīmēm var kad vēlas. Taču unikālo identifikatoru Latvijas zāļu verifikācijas sistēmā jādzēš brīdī, kad zāles izsniedz iedzīvotājiem.
Ārstniecības iestādēm jāpārbauda un jādzēš ar drošuma pazīmēm aprīkotos zāļu iepakojumus jebkurā laikā, kamēr iepakojums ir ārstniecības iestādes rīcībā un zāles tiek izlietotas pacientiem.
Lieltirgotavām zāļu unikālā identifikatora verifikācija jāveic:
- atpakaļ saņemtām zālēm no lieltirgotavas, aptiekas, ārstniecības iestādes vai citas personas, kas tiesīgas iedzīvotājiem piegādāt zāles;
- zālēm, ko saņem no lieltirgotavas, kas nav ne ražotājs vai tirdzniecības atļaujas turētājs lieltirgotājs, ne arī lieltirgotava, kam tirdzniecības atļaujas turētājs ar rakstisku līgumu atļāvis savā vārdā izplatīt zāles, uz ko attiecas tā tirdzniecības atļauja.
Lieltirgotavām zāļu unikālā identifikatora dzēšana Latvijas zāļu verifikācijas sistēmā jāveic, piegādājot ar drošuma pazīmēm aprīkotās zāles sekojošam iestādēm:
- ģimenes ārsta prakses, feldšerpunkti un feldšeru-vecmāšu punkti;
- sociālās aprūpes institūcijas;
- personas, kurām ir zāļu valsts aģentūras izsniegta atļauja zāļu iegādei saskaņā ar farmācijas likuma 48. panta pirmo daļu;
- praktizējoši veterinārārsti un veterinārmedicīniskās aprūpes iestādes;
- ieslodzījuma vietu ārstniecības iestādes;
- neatliekamās medicīniskās palīdzības dienests, tai skaitā iegādājoties zāles valsts materiālajām rezervēm;
- aizsardzības ministrijas nacionālo bruņoto spēku ārstniecības iestādes, kuras zāles iegādājas civilās aizsardzības un katastrofu pārvaldības vajadzībām.
Katra uzņēmuma IT sistēmu var sagatavot tās iekšējie IT nodaļu darbinieki vai uzņēmuma ārpakalpojuma partneri. Katrs uzņēmums pats izvēlas vai nu integrēt zāļu verifikācijas un unikālā identifikatora dzēšanas funkcijas sava uzņēmuma jau esošajā IT risinājumā, vai izmantot to kā atsevišķu IT risinājumu. Tas ir katra uzņēmuma iekšējs lēmums.
LZVO pienākums ir izstrādāt un pārvaldīt nacionālo zāļu verifikācijas sistēmu, kas saņem un glabā informāciju par zāļu drošuma pazīmēm no Eiropas centrālās datu bāzes. LZVO ievieš drošības procedūras, kas nodrošina, ka repozitorijam piekļūt vai informāciju tajā augšupielādēt var tikai lietotāji ar verificētu identitāti, lomu un leģitimitāti.
Latvijas valsts kompetentās iestādes – Zāļu valsts aģentūra un Veselības inspekcija – uzrauga repozitorija darbību, lai pārliecinātos, ka tiek pildītas Deleģētās Regulas prasības.
Deleģētā Regula – Eiropas Komisijas 2015. gada 2. oktobra deleģētā regula (ES) 2016/161, ar ko papildina Eiropas Parlamenta un Padomes Direktīvu 2001/83/EK, nosakot detalizētus noteikumus par drošuma pazīmēm uz cilvēkiem paredzētu zāļu iesaiņojuma.
Farmācijas likums reglamentē fizisko un juridisko personu darbību farmācijas jomā, kā arī nodrošina kvalitatīvu, medicīniski piemērotu un atbilstoša profilaktiska, dziedinoša un diagnostiska līmeņa zāļu ražošanu un izplatīšanu.
Ministru kabineta noteikumi Nr.220 “Zāļu iegādes, uzglabāšanas, izlietošanas, uzskaites un iznīcināšanas kārtība ārstniecības iestādēs un sociālās aprūpes institūcijās”
Ministru kabineta noteikumi Nr.304 “Noteikumi par zāļu ražošanas un kontroles kārtību, par zāļu ražošanu atbildīgās amatpersonas kvalifikācijas prasībām un profesionālo pieredzi un kārtību, kādā zāļu ražošanas uzņēmumam izsniedz labas ražošanas prakses sertifikātu”
Ministru kabineta noteikumi Nr.57 “Noteikumi par zāļu marķēšanas kārtību un zāļu lietošanas instrukcijai izvirzāmajām prasībām”
Ministru kabineta noteikumi Nr.416 “Zāļu izplatīšanas un kvalitātes kontroles kārtība”
Ministru kabineta noteikumi Nr.436 “Zāļu ievešanas un izvešanas kārtība”